生活中制取二氧化碳方法(生活中怎样制取二氧化碳)
1.生活中怎样制取二氧化碳
材料:蜡烛、碳酸氢钠药片(药店有买)、易拉罐、吸管(有橡胶管更好)、橡皮泥、毛巾
步骤: 1、将碳酸氢钠药片捣碎,置于空易拉罐底部。
2、在易拉罐开口处插上吸管(吸管插入罐内3cm即可),吸管周围的缝隙用橡皮泥封好。
3、点燃蜡烛对易拉罐底部加热即可制得CO2。
备注:建议用长型的易拉罐,这样用手拿毛巾夹住易拉罐后,即可进行加热,吸管最好用硬一点、粗一点的。收集装置可用塑料袋或气球。注意:出气口不要密封,防止爆炸
经计算:1g碳酸氢钠可制约0.523gCO2(约0.26L)。
成本:几块钱
也可以往里面加酸(加醋酸前,可以往酸中加一定的盐,因为盐效应,醋酸的解离度会增大,使得制CO2的速度更快)制CO2,至于添加材料的口,你也可以制造一个。
至于用碳酸氢钠药片的原因,是因为该药片中NaHCO3含量百分比远比小苏打中的高。我以前买过,好像1毛钱30粒
2.几种制取二氧化碳的方法
1、方法(1)碳酸钙与稀盐酸反应
CaCO3 +2HCl = CaCl2 + H2O + CO2↑
2、方法(2)碳酸氢钠与稀盐酸反应
NaHCO3 +HCl = NaCl + H2O + CO2↑
3、方法(3)碳酸钠与稀盐酸反应
Na2CO3 +2HCl = 2 NaCl + H2O + CO2↑
4、方法(4)碳酸氢钠受热分解
2NaHCO3 = Na2CO3 + H2O + CO2 (条件:加热)
扩展资料
1、二氧化碳的工业制法:
生石灰和水反应可得熟石灰:CaO+H2O=Ca(OH)2
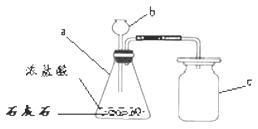
2、实验室制取二氧化碳的方法
药品:石灰石与稀盐酸。
原理:CaCO3+2HCl=CaCl2+H2O+CO2↑
气体收集方法:向上排空气法(密度比空气大,能溶于水)。
检验方法:将制得的气体通入澄清的石灰水,石灰水变浑浊,则是二氧化碳气体。
验满方法:将点燃的木条放在集气瓶口,如木条熄灭,证明已集满二氧化碳气体。
实验室制取二氧化碳应注意
①不能用浓盐酸代替稀盐酸,因为浓盐酸具有较强的挥发性,会使生成的CO2中混有氯化氢气体而不纯。
②不能用稀硫酸代替稀盐酸,因为稀硫酸与碳酸钙反应后生成微溶于水的CaSO4,CaSO4覆盖在石灰石表面,阻止反应的继续进行。不能用碳酸钠代替石灰石,因为Na2CO3易溶于水,与盐酸反应速率快,不利于收集二氧化碳气体。
③长颈漏斗的下端管口应插入液面以下形成液封,防止生成的气体从长颈漏斗中逸散。反应器内的导管稍露出胶塞即可,不宜太长,否则不利于气体的导出。
④收集时瓶口覆盖毛玻璃片,且导管应伸到接近集气瓶底部处,便于尽快排净空气,收集较纯的气体。
⑤检验二氧化碳应用澄清的石灰水而不能用燃着的木条。因为使澄清石灰水变浑浊是二氧化碳的特征反应,而使燃着的木条熄灭的气体除了二氧化碳之外,还有氮气、稀有气体等。
3.制取二氧化碳有哪几种方法
Na2CO3+2HCl=CO2+2NaCl+2H2O
C+O2=(点燃)=CO2
Cu2(OH)2CO3-(加热)-CO2+CuO+H2O
CaCO3+2HCl=CaCl2+H2O+CO2
NH4HCO3 -(加热)-NH3+CO2+H2O
NaHCO3+HCl=H2O+NaCl+CO2
2CO+O2-点燃-2CO2
所有含碳酸根离子和碳酸氢根离子的化合物都可以与酸反应生成CO2
4.制取二氧化碳的三种方法
第一种:固体煅烧,容易混杂固体颗粒,不纯.
第二种:人体呼出含其他气体,不纯.
第三种:在空气中,不只只有氧气,碳和其他气体反应,且不宜收集.
要点:
(1)实验室制取二氧化碳,如选用大理石为原料,则不能选用稀硫酸。 因为生成的碳酸钙是微溶性物质,它包裹在大理石表面,使酸液不能与大理石接触, 从而使反应中止。
(2)实验室制取二氧化碳可用启普发生器,以便随制随用。
(3)收集二氧化碳气体也可用排水法,但水槽中的液体最好选用饱和的碳酸氢钠溶液, 它不会使二氧化碳损失
.注意气密性(第二步),这样防止外界的气体进去,导致制出二氧化碳不纯!
5.制取二氧化碳的三种方法
第一种:固体煅烧,容易混杂固体颗粒,不纯.第二种:人体呼出含其他气体,不纯.第三种:在空气中,不只只有氧气,碳和其他气体反应,且不宜收集.要点:(1)实验室制取二氧化碳,如选用大理石为原料,则不能选用稀硫酸。
因为生成的碳酸钙是微溶性物质,它包裹在大理石表面,使酸液不能与大理石接触,从而使反应中止。(2)实验室制取二氧化碳可用启普发生器,以便随制随用。
(3)收集二氧化碳气体也可用排水法,但水槽中的液体最好选用饱和的碳酸氢钠溶液,它不会使二氧化碳损失.注意气密性(第二步),这样防止外界的气体进去,导致制出二氧化碳不纯。
相关推荐
声明:本网站尊重并保护知识产权,根据《信息网络传播权保护条例》,如果我们转载的作品侵犯了您的权利,请在一个月内通知我们,我们会及时删除。
蜀ICP备2020033479号-4 Copyright © 2016 学习鸟. 页面生成时间:2.935秒









